
――貴センターの重点取り組み課題として、「アンメットメディカルニーズへの挑戦」と「最良のがんゲノム医療をより早く患者さんに届ける」ことが掲げられています。それぞれその内容についてお願いできましたら。
中釜 まず「アンメットメディカルニーズ」について。これは、未だに治療法が見つかっていない疾患に対する医療ニーズのことです。現に患者さんはいらっしゃるものの、薬が開発されていない、あるいは治療法を提供できない、という病気が存在します。がんに関しては、いわゆる希少がん、小児がんなど、患者さんの数そのものが少数のため治療薬開発が遅れがち、という課題を抱えています。
こうした課題はやはり、アカデミア主導で企業との連携を図りながら解決を目指すべきだと考えています。当センターは希少がん対策の拠点としても指定されており、小児がんに関しては同じナショナルセンターである国立成育医療研究センターとも研究に取り組んでいます。また胃がんの中でのスキルス胃がん、肺がんにおける小細胞がんなど、難治性のがんに対してはわれわれが主導的に研究開発を進めるべきだろうと思っています。
そのためにも、患者さんを登録するレジストリが重要です。疾患が希少であるが故に、レジストリによってどこの患者さんが医療ニーズを必要としているのか把握することが可能となります。それがアンメットメディカルニーズへの挑戦の第一歩です。そのためには地域の医療機関の協力も欠かせません。レジストリが構築されれば当センターを始め各医療機関や製薬企業と連携して、治療に向けた研究開発を行っていけるのではないかと考えています。
そして、レジストリを基盤とするもう一つの柱が、「最良のがんゲノム医療の提供」です。
――注目されるテーマですね。
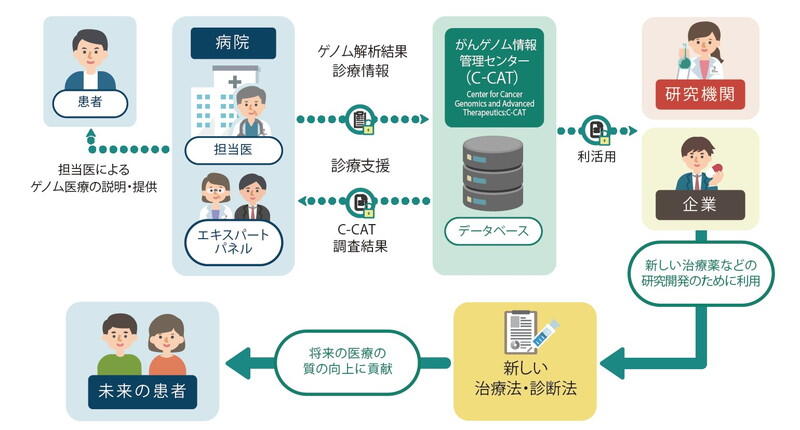
中釜 これはゲノム情報を収集するところから始まります。現在、当センター内のがんゲノム情報管理センター(C-CAT:Center for Cancer Genomicsand Advanced Therapeutics)で、保険診療で行われたがん遺伝子パネル検査によって得られるゲノム情報および診療情報を集約・保管し、利活用を図っています。
このゲノム情報には、患者さんのがん組織に関する極めて詳細な情報が入っています。併せて、治療効果、副作用の有無などの診療情報も収集することで、診療や研究に活用できる有用なデータベースになるのです。同じ疾患に対し同じ薬を投与しながらも、患者さんによって現れる効果が異なってくる、ではなぜ異なるのか、効果が得られた場合それは何故なのかという、より細分化した次なる疑問の解決につながっていきます。このC-CAT登録累計数はこの秋(2022年9月30日時点)、4万1400人となりました。同時に2021年10月から他のアカデミアや企業において、申請と承認のもとゲノム情報と臨床情報を医薬品の研究開発等の目的に使えるようになり、開始から約1年で既に30以上の団体・企業が利活用しています。また国民皆保険制度のもとでがん遺伝子パネル検査が行われる日本のがんゲノム医療体制は、世界に類をみない特長あるものとして海外からも注目されています。今後、次世代の治療薬開発等の成果が得られれば、と期待しています。
全ゲノム解析に向けたデータベース構築と医療DXの率先した取り組み
――それにしても、保険診療でゲノム情報が得られるとは驚きです。
中釜 がん遺伝子パネル(CGP)検査を国民皆保険のもとで実施し、さらに診療情報が付随したゲノム情報を集めて診療や開発研究に利活用するというのは世界にも類を見ない取り組みです。これまでは、最初から意味のあるゲノム情報(タンパク質を創る情報を持つエキソン領域)に照準を当てて有用な情報を得ていましたが、最近の研究ではそれ以外のゲノム領域についても、例えば領域の一部が欠けたり、異なる領域同士が融合(結合)したりといったゲノムの構造変化が発生した場合これまでのCGP検査では捉えることができなかったがんに特徴的な新たな遺伝子情報が抽出できるようになる可能性が出てきました。タンパク質を創る情報を持たない領域(イントロン領域)を含めた、すべての塩基配列情報に対する全ゲノム解析を進めることにより、ゲノム変異の持つ意味がもっと広がり、もしかしたら既存の治療薬の新たな対象となる患者さんが増えてくるかもしれません。既にそうした実例も報告されています。当センターでは、全ゲノム解析による情報もデータベースとして構築するよう準備しており、より広範な利活用に向けて日本のゲノム医療は段階的にスピードアップしている過程にあります。
個人的には、今はがんと難病が主体ではあるものの、解析データが数十万人分まで増えてくると、がん以外の疾患や生活習慣病との相関による影響・リスクも明らかになってくるものと想定しています。がんと同時に他の疾患を抱えている患者さんに対し、この治療薬を投与した場合がんには効果を発揮するけれど他の病気に影響するのかしないのか等、将来も見据えた最適な治療法が見えてくるかもしれません。これは、ゲノム情報を利活用した新しい医療法の開発であると言えるでしょう。
――医療の姿が大きく変わるわけですね。
中釜 ゲノム情報は同時にデジタル情報でもあります。そしてデジタル情報として各種情報がストレージできると、今度はAI(人工知能)がそれを解析することでヒトでは抽出できなかった情報が得られ、それが新たな医療へとつながっていく、そういう時代になりつつあります。これがおそらくAI駆動型の次世代医療の姿になるのではないでしょうか。このように医療の抜本的変化も起こりうる可能性を秘めているのがゲノム情報データベースなのです。
また、患者さんの診療データの活用も重要だと思います。当センター中央病院では、本年10月から、カルテ情報等を集約してデータベース化し、それをもとに新たな治療法や診断法の研究開発に活用していく取り組みを始めました。国においても、レセプトデータや介護データなどを活用し、新しい医療技術の開発や創薬に活用していくための検討が進められており、当センターとしても、こうした医療DXの推進に率先して取り組み、がん医療の一層の充実につなげていきたいと考えています。
集約拠点を通じた均霑化を目指す
――少子高齢化・人口減が進む地方において、がん医療の均霑化を図っていくのも難しい課題だと思われます。
中釜 はい、「がん対策推進基本計画」においても、それは大きなテーマです。そのため全国に約450カ所のがん診療連携拠点病院等が指定され、全国どこでも質の高いがん医療を提供できる体制が構築されています。しかし、均霑化を図る上で、まだまだ課題が残っています。例えば、全ての拠点病院で粒子線治療等の特殊性の高い治療を提供するのは現実的ではありません。その点は、拠点病院間での連携で補完できる体制を整えていく必要があります。
重要なポイントとしては、人材の確保と育成ですが、医療情報の提供一つとってみても、医療にも情報提供にも精通した人材を育成するのは簡単ではありません。そこで模索される方法が、集約化です。私の理解ではすなわち、集約する拠点を作り、その拠点を通すこと、そして情報を共有することによってネットワークが広がり、結果的に均霑化につながる、そういう構図をイメージしています。
これも先述のゲノム医療の提供体制の整備により、一部の特殊性の高い治療のほか、希少がん、小児がんの治療などにおいても、集約化を通じた均霑化を図れるような流れが出てきました。そういう意味では、これからの均霑化は、単に同一の施設要件を満たした拠点病院を一様に整備するのではなく、特性を持った病院との連携や情報の均霑化によって実現していくものと考えられます。つまり医療の均霑化には情報の均霑化が不可欠ですし、情報の均霑化が確立すれば医療の均霑化実現に向けた大きな一歩となると考えられます。
――人材の育成、患者さんのアクセスという点は引き続き課題となりますね。
中釜 人材の不足に対しては、デジタル技術で一定の補完が可能と思われます。育成については、今や一つの施設で1から人を育成していくのはもはや困難な状況ですので、各拠点で情報を共有すると同時に人材の育成も図る、それが今後のあるべき形かな、と考えています。
例えばゲノム医療の専門機関に若手が出向いて、研修しながら知識を涵養し地元に持ち帰るとなると、拠点と専門機関の密な連携と情報共有が不可欠であり、そうした大きな枠組みの中で人材を育てていこう、という発想が求められるのではないでしょうか。そういう意味ではデータを重要なツールとしながらも、最後は連携に関わるヒトとヒトとの問題になると言えるでしょうね。
そしてこのスキームもまた、国内だけでなく海外においても広げていくべきだと思います。ネットワークのスケールが得られれば、受益できる患者さんの数もさらに広がるわけです。現在、われわれはアジア地域の研究開発ネットワークを拡充しています(ATLAS プロジェクト注1、LC-SCRUM-Asia 注2)が、研究の領域に限定せず、医療の均霑化、人材育成に関してどのくらい国際貢献できるか問われる時代になるでしょうから、こうしたスキームを通じてそれを示していく必要があるでしょう。
――誌面を通じて理事長からメッセージなど
中釜 がんに限らず今後の日本の医療においては、やはり国民皆保険制度下で得られる質の高い診療データをいかに活用していくかが最大のカギになると認識しています。それには医療従事者だけではなく、経済界、アカデミア、行政機構を含めて、日本全体の医療の仕組みを刷新していく、という意識の共有が不可欠です。そもそもデータは個人の保有に帰するものですので、適切なセキュリティの下、自身のデータを複数分野の関係者が共有すること、それがやがては共有・活用されることで、ご本人が成果を受益するという将来像を国民全体で共有していくことが肝要です。前述のC-CATでは、登録された方の99・7%が二次利用に同意していただいています。
とはいえなかなか、他の病気はもちろん、がんに罹患されたことのない方を含めて多くの方にゲノム情報などデータ共有のご理解をいただくのは難しいところではありますが、データの共有によって、新しい医療をつくっていくためには、丁寧な説明を行い、理解を求めていくことが必要だと考えます。
その点こそまさに、冒頭でお話したがんの「予防・根治・共生」に欠かせない要素ですので、各関係者が一体となって成果を国民一人一人に還元するという強い意識を持たねばなりません。がんに関する医療DXを強力に推進し、新しい日本の医療体系を構築するために、各界の協力をお願いしたいと思います。
――本日はありがとうございました。
注1 ATLASプロジェクト「アジアがん臨床試験ネットワーク事業(Asia Clinical Trials Networkfor Cancers Project: ATLAS project)」で、ASEAN 諸国の主要ながん研究拠点での治験基盤を整備し、教育研修の機会を提供することで、アジア地域が世界のがん治療開発をリードしていくことを目指しています。
注2 LC-SCRUM-Asia 肺がんで薬物療法を受ける患者さんを対象に、がんの原因となる遺伝子変化(ドライバー遺伝子)を調べるゲノム医療のプロジェクトです。LC は肺がんの英語名Lung Cancerの略語です。日本とアジアの医療者がスクラムを組んで、肺がんの原因となる希少な遺伝子変化を見つけ出し、さらなる個別化治療の確立への貢献を目指しています。
(月刊『時評』2022年12月号掲載)